1) 11β-hydroxysteroid dehydrogenase 2 gene(HHSβD2)


11β-羟基类固醇脱氢酶2基因
2) 11-β hydroxysteroid dehydrogenase type 2


11β羟基类固醇脱氢酶2
3) 11β-hydroxysteroid dehydrogenase type 2


11β-羟基类固醇脱氢酶2
4) 11β-hydroxysteroid dehydrogenase 2 gene


11β-羟类固醇脱氢酶基因
5) human 11β-HSD2 gene


11β-羟类固醇脱氢酶2型基因
6) 11β-hydroxysteroid dehydrogenase


11β-羟基类固醇脱氢酶
1.
The expression of 11β-hydroxysteroid dehydrogenase in diabetes mellitus vasculopathy treated with different concentration of glucose;
不同浓度葡萄糖对血管内皮细胞11β-羟基类固醇脱氢酶基因表达的影响
2.
Correlation between decrease of 11β-hydroxysteroid dehydrogenase activity and hypokalemia induced by furosemide in rats;
速尿对大鼠肾11β-羟基类固醇脱氢酶活性的抑制作用与其低血钾的相关性(英文)
3.
Expressions of 11β-hydroxysteroid dehydrogenase Types 1 and 2 in colorectal cancer cells and effects of glucocorticoid and glycyrrhetinic acid on this cell line
11β-羟基类固醇脱氢酶在人肠癌细胞株中的表达及甘草次酸的作用
补充资料:酶
| 酶 enzyme 生物体产生的具有催化功能的蛋白质。酶是细胞赖以生存的基础。细胞新陈代谢包括的所有化学反应几乎都是在酶的催化下进行的。 分类和命名 按照酶所催化的反应类型,国际酶学委员会 (ICE)把酶分为6大类:① 催化氧化还原反应的叫氧化还原酶。②催化基团 (除氢)转移反应的叫转移酶。③ 催化底物特定部位水解反应的叫水解酶。④催化某些键裂解反应的叫裂解酶。⑤催化底物异构化反应的叫异构酶。⑥催化两个分子连接同时伴有核苷三磷酸(如ATP )水解反应的叫连接酶。酶命名表中的每个酶都有1个编号,前面冠以 EC ,整个编号包括4个数字中间用黑点分开,第一个数字表示酶属于6大类中的哪一类;第二个数字表示酶在该类中下属哪一大组;第三个数字表示酶在该大组中下属哪一小组;第四个数字是酶在该小组内的流水编号。 结构和特性 酶的特殊的生物功能决定于它的特定结构。60年代以来,测定了一系列酶的化学结构,对有的酶还通过X射线晶体衍射。测出了立体结构 、酶分子中结合底物并与催化直接有关的区域叫活性部位。从化学结构看,活性部位一般不是紧挨在一起的连续肽段,而是肽链经过折叠而构成的具有一定大小和几何形状的某一特定空间区域。酶具有催化效率高及催化专一性 。酶活力一般是非 酶催化剂的107倍,与没有催化剂的反应相比,最多可高出1017倍 。1961年国际酶学委员会规定:1分钟内催化1微摩尔底物发生反应所需的酶量为1个酶单位 ,以U表示 。国际纯粹和应用化学联合会(IUPAC)和国际生物化学联合会( IUB )于1972年建议采用酶活力来代替酶单位,即每秒钟转化 1 摩尔底物所需的酶活力为1个katal ,简称 kat ,并建议以每千克酶蛋白具有的kat数或每摩尔酶所含的 kat数来表示酶的比活力与摩尔活力。新旧两种单位之间的关系是 :1U≈ 16.67nkat或1kat=6×107U。目前,新旧单位尚同时并存。 酶的专一性主要有两方面的含义:①对于被作用的底物是专一的。②对于被催化的反应是专一的。 酶活性的调节控制 生物体新陈代谢的调节控制,通常都是通过酶实现的。使酶活性增高的物质叫激活剂;使酶活性下降的物质叫抑制剂。酶活性的调节控制大体上可分为下述3个类型:①通过酶分子化学结构的变化 。② 通过酶分子立体结构的变化。③通过酶分子含量的变化。 动力学与作用机理 米氏方程是1913年德国生物化学家L.米夏埃利斯和M.L.门滕提出的有关酶催化反应速度与底物浓度的关系的方程。用下式来表示: 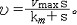 方程中 方程中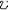 为 反应速度,S为底物浓度,Vmax为最大反应速度,Km为米氏常数。这一方程的基本假设是酶催化反应速度与酶和底物形成的复合物成正比,当酶分子上所有的活性部位都被底物占据后,反应速度达到最大值Vmax。若Vmax以每分钟每分子酶所形成的产物的分子数表示,即为酶的转换率或转换数,以T.N.表示 。而米氏常数Km等于反应速度达到Vmax一半时的底物浓度,它是酶的一个特征性常数。按照化学动力学中比较普遍接受的过渡态理论,一个反应的发生总是有一些键断裂以及另一些键生成。介于原来键断裂和新键生成的中间状态叫过渡态。反应物的基态和过渡态所处的能量状态不同,这个能量差叫能垒。在一定温度下只有部分分子的能量能达到能垒顶部的水平,形成过渡态,然后再转变成产物。当一个反应在酶的参与下进行时,它一般要比原来非催化的反应多经历几步,但由于酶与过渡态中间物的紧密结合,稳定了底物的过渡态结构,从而降低了底物形成其过渡态所需克服的能垒,提高了反应的速度。 为 反应速度,S为底物浓度,Vmax为最大反应速度,Km为米氏常数。这一方程的基本假设是酶催化反应速度与酶和底物形成的复合物成正比,当酶分子上所有的活性部位都被底物占据后,反应速度达到最大值Vmax。若Vmax以每分钟每分子酶所形成的产物的分子数表示,即为酶的转换率或转换数,以T.N.表示 。而米氏常数Km等于反应速度达到Vmax一半时的底物浓度,它是酶的一个特征性常数。按照化学动力学中比较普遍接受的过渡态理论,一个反应的发生总是有一些键断裂以及另一些键生成。介于原来键断裂和新键生成的中间状态叫过渡态。反应物的基态和过渡态所处的能量状态不同,这个能量差叫能垒。在一定温度下只有部分分子的能量能达到能垒顶部的水平,形成过渡态,然后再转变成产物。当一个反应在酶的参与下进行时,它一般要比原来非催化的反应多经历几步,但由于酶与过渡态中间物的紧密结合,稳定了底物的过渡态结构,从而降低了底物形成其过渡态所需克服的能垒,提高了反应的速度。60年代以来,由于物理学、有机化学理论的渗透,以及快速反应、X光晶体衍射分析 、低温酶学等一系列新技术的应用,深化了对酶的作用机理的了解,认为酶催化的高效率是由下述因素共同作用的结果。 ①邻近与定向效应。酶与底物结合后,底物分子中被作用的键,不但接近于酶的活性部位起催化作用的基团,而且以一定的取向排列,提高了起反应的原子间发生碰撞的几率,从而更易形成过渡态。 ②微环境效应与多元催化。酶的活性部位由于局部微环境的影响,使某些酶性基团和碱性基团彼此靠近,或使同一种基团有的带上正电荷,有的带上负电荷,从而发挥了既有酸催化又有碱催化的多元催化作用。 ③底物的形变。在酶的诱导下,底物分子中被作用的键会经受一定的张力,使结合变弱,因而更易断裂。 ④酶构象的变化。酶与底物的作用是相互的,一方面酶诱导底物发生形变,另一方面底物结合在酶上后也会使酶的构象发生一定的变化,使其活性部位的催化基团与底物分子中被作用的键更好地契合。 应用 酶在食品、纺织、发酵、制革等工业中广泛应用,与临床治疗和诊断也有着密切的关系。酶在农业和国防上的应用也有广阔前景 。食品工业中应用的有淀粉酶 、蛋白酶、葡萄糖氧化酶、果胶酶等数十种。60年代以后出现了以酶制剂取代老的发酵法的趋势。70年代始,又发展了固定化酶的新工艺。农业方面的应用主要集中在杀虫剂农药上。在医学方面,人体的许多疾病与酶的正常催化作用受到干扰破坏有关。血清酶学诊断是重要的临床诊断手段。当人体患有某种疾病时,一些组织或器官就会发生病变,细胞破损,许多酶就会随之进入血流,使得这些酶在血清中的含量和活性明显升高。许多化学药物、抗生素的治疗原理,基本上是它们能选择性地作用于致病微生物体内的某一酶系,从而阻断该病原微生物的正常代谢,导致它们的死亡。而这种药物对人体无害或危害较小。此外,酶也可直接用作药物。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条