1) atomic weight


原子量
1.
In the domestic academe "atomic weight" has been changed to "relative atomic mass".


"原子量"(atomic weight)这一广为大众熟知的术语却遭到"相对原子质量"(relativeatomic mass)的冲击,国内已将"原子量"改名为"相对原子质量"。
2.
% 76 Ge,and the atomic weight of germanium as 72 639(4) both with an uncertainty given on t.
0 5 原子 %76Ge再各乘以已知的原子质量 ,得出锗原子量的新值为 :Ar( Ge) =72 。
3.
The atomic weight of europium is 151.


用该值和已知的铕的核素质量,计算得到铕的原子量为151。
2) atomic weight


原子量原子重量
3) Cu atomic weight


铜原子量
1.
A microscale experiment using simple instrument was applied to the determination of Cu atomic weight.
利用自制的简易气体发生器和洗气装置对铜原子量测定微型实验作了进一步的探索与实践 。
4) Atomic mass


原子质量
1.
By using molecular dynamics simulation the effect of atomic mass of dopants on lattice vibration in silicon has been researched,the evolution of phonon scattering from point defects has been explicitly displayed in the atomic scale,which can not be currently observed by actual experiments.
本文采用分子动力学方法,重点研究了掺杂原子质量对硅晶格振动行为的影响,在原子尺度上清楚地展示出目前实际无法展现的点缺陷影响声子散射的演化过程。
5) atomic energy


原子能量
1.
Calculation of atomic energy using partial-wave method for plasmas at medium-low temperature;
中低温等离子体原子能量的分波法计算
6) atomic parameters


原子参量
1.
The atomic parameters of the transmition 2s22p6-2s22p53s of Ne-like ions with nuclear charge Z from 13 to 27, including energy level, oscillator strength, spontaneous radiation deay time, level life, electron-collision excitation cross-section, electron-collision excitation rate and so on are obtained by using Hartree-Fock-Roothan (HFR equations).
利用多组态求解相对论性的Hartree Fock Roothan方程 (HFR)方法计算了类氖离子 (Z =13~ 2 7) 2s2 2p6 2s2 2p53s能级之间跃迁的原子参量 ,包括类氖氩激光系统的能级 ,振子强度 ,自发辐射衰变速率 ,能级寿命 ,电子碰撞激发截面及电子碰撞激发速率系数等。
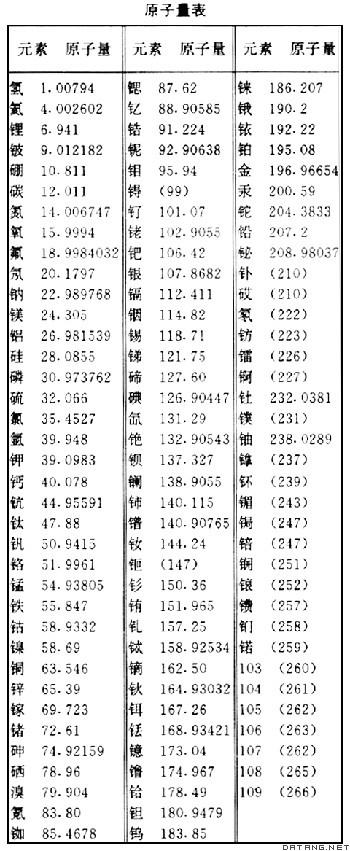
补充资料:原子量
| 原子量 atomic weight 以12C 的原子量的 1/12为基准的各种元素的相对平均质量。由于它是一种相对比值,故不列单位。绝大多数元素是由两种或两种以上同位素组成的,因此原子量是按各同位素丰度取平均值,所以它具有平均概念。 原子量是英国J.道尔顿首先提出的:“每一种元素的原子都有一定的重量,同种元素的原子的重量都相同。”但原子极小,既无法取出某元素的一个原子,而且原子的质量又极轻,不可能用直接方法称量,因此历史上一直选择某一种元素的原子量作为标准,将其他元素与之比较,得到各种元素的相对重量,就被称为原子量。现在,虽然可以用称量1摩尔某元素的原子得到其摩尔质量,然后用它除以阿伏伽德罗数,得到以克为单位的某元素的质量,但这个值极小,用起来很不方便,所以仍然使用相对原子量。
1803年道尔顿用氢的原子量为1作为相对原子量的基准,1826年J.J.贝采利乌斯改为氧原子量的 1 /100为基准,1860年J.-S.斯塔建议用氧原子量的1/16为基准, 沿用了很长时间。1929年W.F.吉奥克和H.L. 江斯登发现天然氧中存在着16O、17O 、18O三种同位素 ,它们在自然界的分布不完全均匀,因此用天然氧作为原子量基准就欠妥。后来物理学界改用16O的1/16 作为原子量基准,化学界还沿用原来的基准,从此原子量出现两种标度,1940年国际原子量委员会确定以1.000275作为两种标度的换算因子: 物理原子量=1.000275×化学原子量 存在两种标度必然经常引起混乱。1959年,在慕尼黑召开的国际纯粹与应用物理学联合会上,德国J.H.马陶赫建议12C=12作为原子量基准,并提交国际纯粹与应用化学联合会考虑,后者于1960年接受这一建议。1961年,在蒙特利尔召开的国际纯粹与应用化学联合会上,正式通过这一新基准。 |
说明:补充资料仅用于学习参考,请勿用于其它任何用途。
参考词条